김정식수석님 발표는 언제나 많은 준비를 해오시고 많은 것을 전해주셔서 과부하가 걸릴 정도....
도대체 이 많은 것들을 다 언제 개발하고 설명서까지 마련하시는지....ㅎㅎㅎ
홈페이지에서 많이 봤었지만 직접 실험을 통해 배우는 시간은 또 다르다.
만나면 행복한 시간을 주신다. ㅎㅎㅎ
수업 하시기 전에 언제나 처럼 참고할 사이트를 주시고 실험재료도 나누어주신다.
https://t.ly/R3LE





1. 팝업 종이 이용한 달의 크기 찾기
달 크기를 별다른 도구 없이 쉽게 측정하게 하기 위해 달크기 측정용 팝업 학습지를 제공한다.
1) 활동지를 3번 접어서 막대 모양으로 만들고, 그 다음 가위로 자른다.
2) 달크기는 삼각형의 닮은비만 알면 쉽게 측정할 수 있다.
전형적인 실험의 경우 50cm 자에 구멍이 뚫린 종이를 끼워서 달의 크기를 측정한다.




거리 측정하는 장치는 거리 센서를 활용한 장치 (2만원이면 산단다. 살 계획)를 이용한다.
뚫린 구멍 안에 측정할 물제인 달이 들어오는 거리를 측정하여 비례식으로 계산한다.
우리는 벽에 걸린 시계를 이용항여 시계를 달로 하여 반지름 계산을 하였다.



2. 과학실 물품 검색하는 방법도 안내


3. 표면장력 물 붓기 실험
모둠끼리 돌아가면서 물을 붓다보면 표면장력이 깨져서 넘치는 점을 찾아보는 활동이다.
생각보다 표면위로 높이까지 물을 쌓을 수 있다.
학교에서 학생들과 바닥면의 종류에 따른 표면장력 구하는 활동을 했었는데 이런 것도 더 재미있을 것 하다.












4. 탄산음료 흔들고 나서 거품이 안나게 따는 방법
1) 흔든 사이다캔을 옆으로 뉘어서 3번 정도 왕복해서 굴려 준다.
탄산음료가 들어있는 캔이 흔들리면 음료수 안에 녹아있던 이산화탄소가 빠져나와 기포가 만들어지고 이 기포들이 캔 옆면에 달라 붙게 된다. (사이다를 유리잔에 따르면 유리잔 옆면에 기포가 달라 붙는 것을 볼 수 있다.)
물리적으로 캔안의 압력은 증가하지 않는다고 한다. 다만 작은 이산화탄소 기포들이 생겨나서 압력이 낮아지면 쉽게 이산화탄소가 빠져 나올 수 있는 조건이 만들어 졌다고 보는게 맞다.
이때 갑자기 뚜껑을 따면 캔안의 압력이 급격히 감소하게 되고, 보일의 법칙에 의해 벽면에 붙어있던 기포들의 부피가 순간적으로 증가하게 된다. 벽면에 붙어있는 기포들 수가 많기 때문에 한꺼번에 기포들의 부피가 팽창하면 탄산음료가 밖으로 밀려 나오면서 거품과 함께 탄산음료가 뿜어져 나오게 되는 것이다.
캔을 눕혀서 굴리면 탄산음료 수면이 캔안에서 마치 불도저처럼 벽면에 붙어있는 기포들을 떼어내게 된다. 떨어진 기포들은 터지거나 아니면 탄산음료 위쪽으로 모이게 된다.
3번정도 굴린다음 뚜껑을 따면 남아있는 기포들의 부피가 증가하겠지만 위쪽에 모여 있어 더이상 밀어올릴 탄산음료가 없게 되어 뿜어져 나오거나 넘치지 않게 되는 것이다.
2) 그냥 뉘어놓은 상태에서 시간을 기다린다.
흔들다가 10, 20, 30, -....60초에 뚜껑을 열어보면 60초일 때는 넘쳐흐르지 않는다.





흔들다가 뚜껑을 여는 순간에 액체가 뿜어져 나온다. 60초 지난 후의 페트병은 거품이 나오지 않는다.


5. 탄산수 병을 흔들면 병 내부 압력은 어떻게 변화할까?
압력센서를 이용하거나 압력 측정기를 이용하는 것이 어렵기도 하고 즉각적으로 보이지가 않는데
오늘 주사기를 이용한 압력 측정이 너무 좋았다.
10mL용 작은 주사기인데 주사기 끝을 막을 수 있는 덮개가 있다.
이 주사기를 최대한 부피를 크게 하여 막는다. 공기중의 상태를 1기압이라 할 수 있다.
이 주사기를 탄산수 안에 넣어 흔들었을 때의 압력을 측정할 수 있다.






흔들고 난 후의 압력이 커져서 주사기 안의 부피가 작아짐을 알 수 있다.




6. 탄산수 병이 버티는 압력 구하기
1.5L 페트병과 500mL 병이 버틸 수 있는 압력은 어디가 클 것인가?
( https://www.facebook.com/watch/?v=906747422690080 )
1.5L 페트병은 10기압까지 500mL 병은 16기압까지 버틸 수 있었다.



이탄 뚜껑을 사용하였다.

7. 얼린병과 물병을 굴리면 누가 빨리 내려올까?
준비물 : 빈 병, 물이 절반 든 병, 물병, 절반만 얼린 병, 전체 얼린 병


1. 빈 병 < 물병
2. 물이 절반 든 병 < 물병
3. 물병 > 절반만 얼린 병
4. 얼린 병 < 물병
5. 절반만 얼린 병 = 전체 얼린 병
6. 빈 병 < 얼린 병
얼린 병과 물병 중 어떤 것이 빨리 굴러가는지 확인하는 다른 방법은 두 병을 겹쳐서 굴려 보면 된다.
7. 물병위에 얼린병을 위치시키고 굴리면 물병 속도가 빠르므로 함께 굴러 내려간다.
8. 물병과 얼린병 위치를 바꿔서 나란히 굴리면 속도 빠른 물병과 속도 느린 얼린 병 사이가 점점 벌어진다.
<과학적 원리>
병들이 굴러 내려가는데 속도 차이가 나는 이유는 에너지 전환으로 설명할 수 있다.
만약 위병들을 같은 높이에서 자유낙하 시킨다면 모든 병은 거의 똑같이 바닥 면에 도달할 것이다.
만약 마찰력이 전혀 없어서 경사면을 굴러 내리지 않고 미끄러져 내려간다면 마찬가지로 모든 병은 거의 똑같이 바닥 면에 도달할 것이다.
바닥 면에 도달하는 시간에 차이가 나는 이유는 내려오면서 병이 회전하기 때문이다.
위치에너지가 모두 운동에너지로 사용되지 못하고, 중간에 회전에너지로 손실이 일어나게 되는 것이다. 즉 회전에너지를 더 많이 사용하는 병은 더 천천히 내려오게 된다.
비교해 보면 바닥 면에 도달하는 순서는 아래와 같다.
물병 > 물이 절반 든병 > 얼린병 = 절반만 얼린 병 > 빈 병
아래 그림처럼 회전 운동에너지(관성모멘트)를 비교해 보면, 속이 빈 원통이 속이 찬 원통보다 회전에너지가 더 크다.
즉 빈 병이 회전하는데 에너지를 가장 많이 사용한다는 걸 알 수 있다.
사실 이론적으로 모든 병의 질량이 같지 않기 때문에 정확한 실험이라고 보기는 어렵다. 하지만, 이 실험에서 질량은 거의 영향을 미치지 않는다(자유낙하 하는 물체의 속력은 질량과 상관이 없는 것처럼)고 봐도 된다. 이론적으로는 전체 얼린 병이 절반만 얼린 병보다는 아주 조금 더 빨리 굴러내려야 하지만, 절반만 얼린 병의 비어 있는 부분이 얼음이 있는 부분보다 질량이 상당히 작아서 끼치는 영향은 미미하다고 볼 수 있다.
8. 페트병을 이용한 기압실험
개인적으로는 4월에 학생들과 했었던 실험인데 더 쉬운 방법으로 하신 내용을 홈피에 올려놓으셨다.


9. 탄산수 내부에 녹아있는 이산화탄소의 양 측정(기체 용해도 )
헨리의 법칙에 의하면 부분압을 고려한 기체의 용해도 식은
P=K × S 가 된다.
이때
P는 기체 분압(atm)
K 는 25도일 때 물에 대한 이산화탄소 헨리상수 29.76 atm/(mol/L)
S 는 리터당 몰 용해도(mol/L)
탄산수 1L 내부 압력이 3기압이라고 하면
P = K × S
3기압=29.76 × S
S=0.1008M
3기압에 녹아 있는 이산화탄소의 양은 0.1008mol 이 된다.
이산화탄소 1mol 이 44g 이므로 0.1008mol × 44g/mol = 4.43g의 이산화탄소가 녹아 있다는 것을 알 수 있다.
따라서 물 1L에 25도 3기압에 녹아있는 이산화탄소 양은 4.43g
이산화탄소 몰수는 0.1008 mol 이므로
모두 기체로 바뀌었을 때 이산화탄소 부피는 2.258L 가 된다. (0.1008mol × 22.4L)
(0도가 아니라 25도 이기 때문에 샤를의 법칙에 의해 부피는 298/273 만큼 증가하겠지만 일단은 무시하기로 한다. )
헨리의 법칙에 의하면 기압과 용해도는 비례하므로
물 1L에 녹아있는 이산화탄소 양은 1기압이 증가할때 마다
1.48g (약 1.5g)씩 더 녹아 들어간다는 것을 알 수 있다.
3기압 탄산수 1L를 흔들어 이산화탄소가 모두 빠져 나오면, 탄산수에서 빠져나온 이산화탄소 부피는 약 2.25L라는 걸 알 수 있다.
탄산수 입구에 풍선을 씌워서 흔들면 빠져나온 이산화탄소를 이용해 풍선을 부풀게 할 수 있는데, 일반적으로 풍선을 불 수 있는 압력이 약 1.02기압 정도이기 때문에, 위 그래프에서 2기압차이 만큼만 이산화탄소가 빠져 나온다. 약 1.5L 부피만큼 이산화탄소가 빠져나온다는 거 .
풍선의 부피가 1.5L가 되면 풍선의 반지름은 얼마나 될까? 구 부피를 계산하는 공식에 넣어 보면 금방 알 수 있다. 부피는 반지름의 세제곱에 비례하므로

계산해 보면 풍선의 부피가 1.5L 일때 풍선의 반지름은 약 7.1cm(지름 14.2cm) 정도 된다.











10. 헤론 분수 만들기
1. 준비물
: 페트병 3개, 이탄뚜껑(구멍이 2개 뚫린 이산화탄소를 이동시키기 위해 만들어진 페트병 뚜껑, ) 3개,
일회용 스포이트(1ml) 1개, 가위
비닐튜브(내경4X외경6mm) 2m 필요 : 50cmX3개, 25cm X2개로 잘라서 사용

* 비닐튜브나 스포이트를 끼울 때는 따뜻한 물에 담가 부드럽게 하거나, 볼펜으로 입구를 넓혀서 끼우면 편리하다.
<헤론의 분수 만들기>
1. 연결 구멍 2개가 뚫린 페트병 뚜껑 3개를 준비한다.
- 직접 뚫어도 되지만 이탄뚜껑을 이용하면 편리하다.

2. 페트병 내부 한쪽만 튜브가 바닥에 닿도록 뚜껑에 끼워 긴 관을 만든다. 이런 페트병 2개를 준비한다.

3. 2개의 페트병을 길이가 짧은 쪽 구멍 끼리 튜브로 연결한다.

4. 페트병 하나는 절반 쯤 자르고, 뒤집어서 기존 페트병 2개에 그림처럼 연결한다. 이때는 긴 관쪽 구멍과 연결하면 된다.

5. 뒤집어 놓은 페트병 뚜껑 한쪽(일단 왼쪽)에 분수관(일회용 스포이트 절반 자른 것)을 끼운다. (잘 안들어가면 스포이트 입구를 볼펜등으로 너ᇸ혀서 넣는다)

6. 왼쪽 페트병에 물을 채우고 오른쪽 페트병 보다 높은 곳에 위치 시킨다. 그리고 뒤집어 진 페트병에 물을 약간 부어주면 물이 순환하면서 분수가 나온다. 위쪽 병에 물이 다 사라지면 더 이상 분수는 작동하지 않는다. 그럼 아래쪽 병에 있는 물을 다시 위쪽병으로 옮겨주면 또 다시 작동하게 할 수 있다.

7. 뚜껑을 열고 다시 물을 채우는 것이 불편하기 때문에, 물이 더이 상 나오지 않으면 뒤집어 놓은 페트병 뚜껑의 분수관을 오른쪽으로 옮기고 왼쪽 페트병은 내리고 오른쪽 페트병을 올려 페트병 높이만 바꿔도 다시 분수가 나온다.

<과학적 원리>
1번 분수에 물을 부으면, 수압차에 의해 1번 분수에 있던 물이 2번 페트병으로 흘러 내려간다. 그럼 2번 병에 있는 공기가 압력이 커져서 적색 연결관을 따라 3번 페트병으로 이동하게 된다. 3번 페트병에 공기가 이동해 오면 기압이 커지게 되고, 증가된 기압은 3번 페트병에 있는 물을 파란색관을 통해 1번 분수관으로 밀어올리게 된다. 그럼 1번 분수에서 물이 나온다. 뿜어져 나와 고인물은 다시 2번 페트병으로 흘러 내려가면서 같은 작용이 반복되면서 계속해서 분수가 나오게 된다.
단 3번 페트병의 물이 다 없어지거나 2번 페트병에 물이 가득차면 관속에 든 물 때문에 수압차가 생기지 않아 더 이상 분수는 작동하지 않는다. 뚜껑을 열어 2번 페트병에 모인 물을 다시 3번 페트병으로 옮겨 주고 뚜껑을 닫으면 분수가 작동하게 된다. 그런데 매번 뚜껑을 열고 물을 옮기는 일은 생각보다 불편하다.
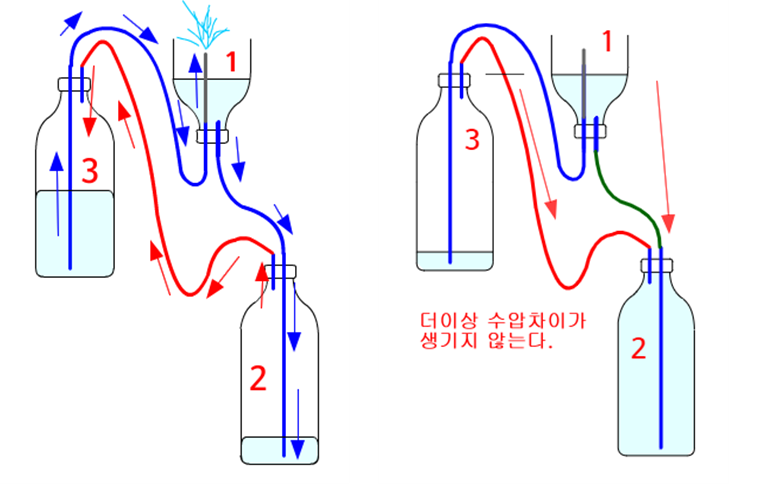
2번과 3번 페트병의 높이차가 없다면 어떻게 될까? 그럼 분수는 작동하지 않는다.
1번 페트병 높이도 중요하지만 사실은 1번과 2번 페트병의 수압차이가 1번과 3번 페트병의 수압차이보다 커야지만 물과 공기가 이동한다는 것을 알 수 있다.
따라서 1번과 2번 페트병이 고정된 상태에서 3번 페트병을 높이 올리면 올릴수록 분수는 더 잘 나오는 것을 볼 수 있다. 정확하게 말하면 1-2번 페트병의 수압차이는 클수록 1-3번 페트병의 수압차이가 작을수록(3번 병이 1번 병보다 더 수압이 세서 음수가 되면 더 좋다.) 될수록 분수가 잘 나온다.
<추가>
이번 실험은 예쁜 모양을 만드는 것 보다는 원리를 파악하는데 중점을 두었다. 그리고 한번 작동이 끝나면 뚜껑을 열고 물을 다시 채우는 과정이 불편하기 때문에 쉽게 분수를 작동시키는 방법을 추가로 고민해 보았다. 물을 옮기지 않아도 간단한 방법으로 해결 할 수 있다. 원리를 탐구해 보면 알겠지만, 2번페트병을 3번 페트병 보다 더 높이 올리고, 1번 페트병에 분수관 위치만 바꿔 주면 똑같은 원리로 작동한다는 것을 알 수 있다. 뚜껑을 열고 물을 옮기지 않아도, 분수관 위치와 2,3번 페트병의 위치만 바꿔 주는 것 만으로 분수를 계속 작동하게 할 수 있다.
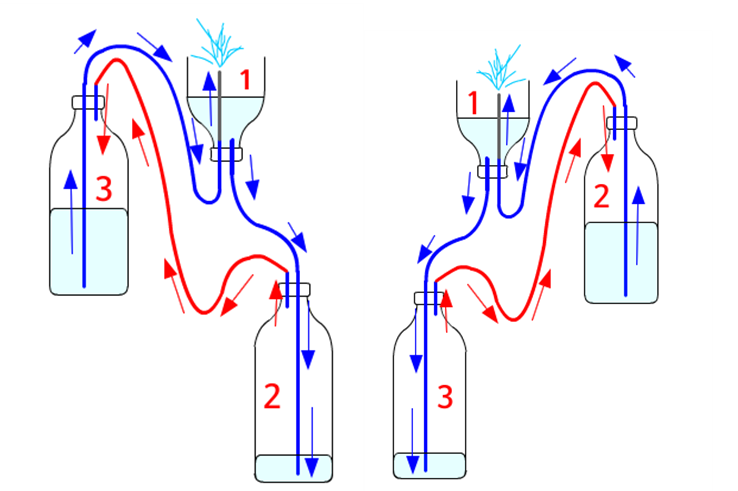
<응용>

'학교&교과서' 카테고리의 다른 글
| 신과수 6월워크숍4- 회원나눔 (0) | 2023.06.10 |
|---|---|
| 신과수 6월워크숍3- 박은숙, 한은선 (0) | 2023.06.10 |
| 신과수 6월워크숍1- 조미형, 김경희 (0) | 2023.06.10 |
| 체육한마당 (0) | 2023.05.25 |
| 수원수석교사 모임 (0) | 2023.05.24 |